La Food and Drug Administration ha retirado su apoyo provisional al uso de Evusheld, un medicamento que en su día fue una valiosa herramienta para evitar que los pacientes con sistemas inmunitarios debilitados enfermaran gravemente de COVID-19.
Con nuevas variantes virales cada vez más hábiles para derrotar a Evusheld, la FDA dijo que el medicamento biológico ya no debe ser utilizado.
La decisión de la FDA marca el final -al menos por ahora- de un medicamento que había ayudado a devolver cierta normalidad a las vidas de pacientes con cáncer, receptores de trasplantes y otras personas que no podían vacunarse contra COVID-19 o cuyos sistemas inmunitarios no respondían bien a la vacuna. Se cree que hasta un 3% de la población estadounidense -7,2 millones de adultos- padece deficiencias inmunitarias que les exponen a enfermar gravemente o morir si se infectan con el virus pandémico.
“Es un momento realmente triste”, afirmó la Dra. Camille Kotton, médica especialista en enfermedades infecciosas del Hospital General de Massachusetts que atiende a personas con inmunodeficiencias. Para sus pacientes, dijo, “es como si te dijeran que los cinturones de seguridad de tu coche ya no funcionan, y no vamos a poder sustituirlos por nada.”
En los últimos meses, nueve nuevas subvariantes de la cepa dominante Omicron han demostrado ser capaces de burlar las defensas de Evusheld. En conjunto, esas subvariantes constituyen ahora más del 90% de las muestras de coronavirus SARS-CoV-2 que circulan en Estados Unidos, según los Centros para el Control y la Prevención de Enfermedades.
El resultado: Después de 15 meses en el arsenal nacional contra el COVID-19, un medicamento para cuyo desarrollo y producción los contribuyentes estadounidenses gastaron al menos 1.580 millones de dólares ha resultado en gran medida ineficaz. Sin embargo, la FDA dijo que su autorización para el medicamento se reanudaría si al menos el 10% de los especímenes de coronavirus en circulación son susceptibles a él en el futuro.
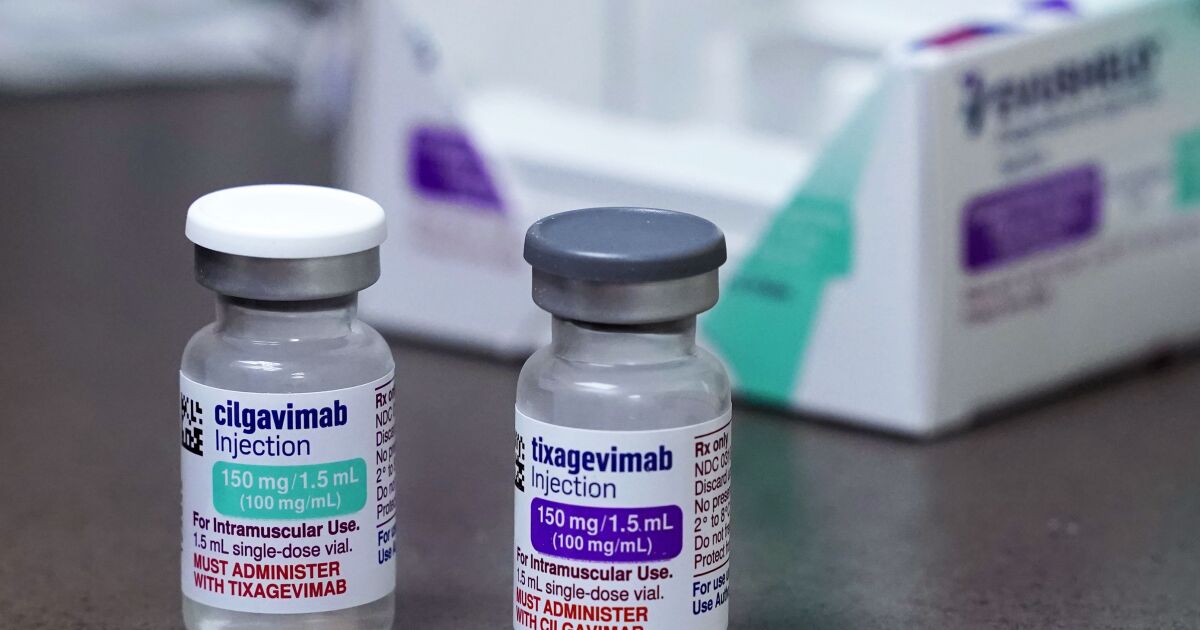
Evusheld es el nombre comercial de un medicamento de AstraZeneca que combina dos anticuerpos monoclonales, tixagevimab y cilgavimab. En un comunicado el viernes, el gigante farmacéutico británico-sueco dijo que está probando la seguridad y eficacia de un nuevo medicamento de anticuerpos para proteger a las personas con sistemas inmunes debilitados, que espera poner en el mercado en la segunda mitad de 2023.
Cuando Evusheld se puso a disposición de los pacientes hace poco más de un año, su protección permitió a muchos pacientes inmunodeprimidos salir del aislamiento por primera vez desde que comenzó la pandemia.
Estaba previsto que se administrara a los pacientes que lo necesitaran cada seis meses. Pero algunos nunca recibieron la primera inyección, y muchos no recibieron la segunda, antes de que los cambios en el coronavirus la hicieran ineficaz.
“Estamos de luto por la muerte oficial de lo que había sido una herramienta realmente buena”, dijo Kotton.
Muchos médicos ya habían aceptado que el tiempo de Evusheld había pasado.
Los médicos del UCLA Medical Center y sus satélites dejaron de administrarlo a sus pacientes de trasplante y quimioterapia en diciembre. Fue entonces cuando la subvariante Omicron conocida como BQ.1.1., que había encontrado la forma de burlar la protección de Evusheld, se hizo dominante en todo el sur de California.
“Es lamentable”, dijo la Dra. Tara Vijayan, médica infectóloga de la UCLA. Pero, añadió, “nos sorprendió que la FDA esperara tanto para retirarlo”.
Gracias al ritmo incesante al que han surgido nuevas variantes del coronavirus, una serie de medicamentos contra el COVID-19 basados en anticuerpos monoclonales de bioingeniería han quedado obsoletos.
Desde noviembre de 2020, cuando los primeros tratamientos de este tipo contra el COVID-19 obtuvieron el apoyo provisional de la FDA, seis han quedado inutilizados por cambios genéticos en el coronavirus. Comenzó con la aparición de la variante Delta en marzo de 2021, y la llegada nueve meses después de la variante Omicron -que a su vez se ha escindido en 18 subvariantes- ha acabado con el resto.
Desde abril de 2021, la FDA ha retirado su autorización de uso de emergencia para todos los tratamientos con anticuerpos monoclonales utilizados como terapias para la COVID-19, excepto para el tocilizumab, que sigue utilizándose en algunos pacientes hospitalizados.
A medida que los médicos de la UCLA veían fracasar una tras otra de sus terapias con anticuerpos monoclonales, “siempre aconsejábamos una medida de precaución”, dijo Vijayan, director médico de administración antimicrobiana en adultos del sistema de salud. “Siempre estábamos esperando las variantes y la resistencia que vendría con ellas”.
Los triunfos del virus sobre estas sofisticadas terapias han dejado a todos los pacientes de COVID-19 con una menguante reserva de fármacos de rescate. Pero para los pacientes con inmunidad comprometida, la situación es aún peor.
La incesanteEl cambio de forma ha acabado más completamente con el almacén de medicamentos eficaces que pueden salvarles de una enfermedad grave o de la muerte con COVID-19. Muchos no pueden tomar el antiviral Paxlovid porque interactúa con sus otros medicamentos. Eso les deja con el antiviral menos eficaz molnupiravir y el fármaco remdesivir, que debe infundirse diariamente -generalmente en un hospital- durante tres días.
La escasez de fármacos disponibles para pacientes con sistemas inmunitarios comprometidos ha renovado el interés por el plasma convaleciente, una versión de la vieja escuela de la terapia con anticuerpos que se exploró por primera vez en los primeros días de la pandemia. Como las terapias para estos pacientes frágiles han disminuido, varias sociedades médicas han recomendado volver al uso de productos sanguíneos extraídos de pacientes previamente infectados que se han recuperado.
Una revisión sistemática de ensayos clínicos publicada recientemente sugirió que el plasma convaleciente podría ayudar a prevenir la muerte en pacientes COVID-19 hospitalizados con inmunidad deteriorada. Y un ensayo clínico británico está probando actualmente el uso de “Vax-Plasma” – plasma de personas vacunadas que sufrieron infecciones graves y luego se recuperaron.